Basiskennis chemie 4/Organische chemie/Carbonzuren
Carbonzuren
Eigenschappen
- De carbonzuren hebben, zeker vergeleken met de alkanen, maar ook met de alkanolen, met hetzelfde aantal koolstof-atomen relatief hoge smelt- en kookpunten:
| Aantal Koolstof |
Alkaan | Alkanol | Carbonzuur | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Naam | Smeltpunt | Kookpunt | Naam | Smeltpunt | Kookpunt | Naam | Smeltpunt | Kookpunt | Kz[2] | |
| 1 | Methaan | -182 | -164 | Methanol | -94 | 65 | Methaanzuur | 8 | 100 | 17.80*10-5 |
| 2 | Ethaan | -183 | -89 | Ethanol | -114 | 78 | Ethaanzuur | 17 | 118 | 1.78*10-5 |
| 3 | Propaan | -188 | -42 | Propan-1-ol | -127 | 97 | Propaanzuur | -23 | 141 | 1.32*10-5 |
| 4 | Butaan | -138 | -1 | Butan-1-ol | -90 | 117 | Butaanzuur | -4 | 164 | 1.51*10-5 |
| 5 | Pentaan | -129 | 36 | Pentan-1-ol | -78 | 138 | Pentaanzuur | -19 | 185 | 1.51*10-5 |
| 6 | Hexaan | -95 | -69 | Hexan-1-ol | -45 | 157 | Hexaanzuur | -2 | 205 | 1.32*10-5 |
IUPAC-Naamgeving
Als het molecuul een carbonzuurgroep bevat, is dat altijd de uitgang. Alle andere groepen worden als substituenten behandeld.
| 1 Zuurgroep | 2 Zuurgroepen | 3 of meer Zuurgroepen | |
|---|---|---|---|
| 1 | Als de rest van het molecuul uit een aromaat bestaat wordt de naam gevormd door de aromaatnaam, gevolgd door "carbonzuur". Bijvoorbeeld: benzeencarbonzuur. De rest van de naamgevingsregels voor zuren kun je dan overslaan. Substituenten moeten wel vermeld worden. | ||
| 2 | Zoek de langste koolstofketen waarin ook het koolstof-atoom van de zuurgroep voorkomt. | Zoek de keten op waarin beide zuurgroepen voorkomen | Zoek de keten op waaraan de meeste zuurgroepen gebonden zijn. |
| 3 | Tel alle koolstofatomen in de langste keten, inclusief de koolstofatomen in de zuurgroep(en). | Tel de koolstofatomen zonder de koolstofatomen in de zuurgroepen. | |
| 4 | Het aantal koolstofatomen dat je in de vorige stap gevonden hebt bepaalt de stamnaam (1: methaan; 2: ethaan; etc). | ||
| 5 | Zet achter de stamnaam "zuur" | Zet achter de stamnaam "dizuur" | Zet achter de stamnaam het juiste Griekse telwoord en "carbonzuur" |
| 6 | Heb je plaatsnummers voor substituenten nodig, dan heeft het koolstof-atoom van de zuurgroep altijd nummer 1. | Als je voor substituenten plaatsnummers nodig hebt geldt: rangschik de substituenten alfabetisch en komt een zo laag mogelijk nummer zo vroeg mogelijk in de naam. | De zuurgroepen worden zo genummerd dat een zo laag mogelijke nummer zo vroeg mogelijk in de naam komt. De plaatsnummers voor de zuurgroepen komen tussen de stamnaam en het Griekse telwoord voor de zuurgroepen. |
| Voorbeelden | |||

|
|||
| 1 | De rest van het molecuul is aromatisch. De aromaat is benzeen. De plek op de benzeenring met de zuurgroep krijgt een zo laag mogelijk nummer: 1, het laagst mogelijke nummer voor het chloor-atoom is nummer 3: 3-Chloorbenzeencarbonzuur | ||

|

|
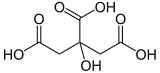
| |
| 2/3 | Langste koolstofketen heeft 4 koolstof-atomen. | Keten me beide zuurgroepen heeft 4 koolstof-atomen. | Keten waaraan de meeste zuurgroepen gebonden zijn heeft 3 koolstof-atomen. |
| 4 | butaan | butaan | propaan |
| 5 | butaanzuur | butaandizuur | propaan-1,2,3-tricarbonzuur |
| 6 | Substituent is hydroxy op plaats 4: 4-Hydroxybutaanzuur | Substituent is hydroxy op plaats 2: 2-Hydroxybutaandizuur | Substituent is hydroxy op plaats 2: 2-Hydroxypropaantricarbonzuur |
- De verbinding bevat een zuurgroep (-COOH).
- De langste keten mét de zuurgroep heeft vier koolstofatomen.
- De stamnaam is dus butaan.
- Met het achtervoegsel "zuur" wordt dat dus: butaanzuur.
- De hydroxylgroep is de enige substituent, maar die kan wel op drie verschillende plekken zitten. Het koolstof-atoo van de zuurgroep zit "vol". Er zijn twee bindingen voor het dubbelgebonden zuurstof nodig, één voor de hydroxylgroep en nog een om de groep met de rest van het molecuul te verbinden. Het koolstof-atoom van de zuurgroep krijgt nummer 1, dus de hydroxy-groep zit op plek 4.
- De naam van de verbinding wordt dus: 4-hydroxybutaanzuur.
4-hydroxybutaanzuur
Carbonzuren α-β-naamgeving
- α-aminozuren
- Aan het eerste koolstof-atoom naast de zuurgroep is een amino-groep ( gekoppeld. α-aminozuren zijn erg belangrijk in de biologie. In de IUPAC-naamgeving heten deze zuren: 2-aminocarbonzuren. In het hoofdstuk over aminozuren wordt dieper ingegaan op deze groep verbindingen.
- GABA
- γ-aminoboterzuur (γ is de derde letter in het Griekse alfabet, de afkorting komt uit het Engels: Gamma-AminoButyric Acid). De aminogroep bevindt zich op het derde koolstof-atoom naast de zuurgroep. De stof speelt een rol in de communicatie tussen hersencellen.
- GHB
- gamma-hydroxyboterzuur. In plaats van een amino-groep bevindt zich een hydroxylgroep op het derde koolstof-atoom naast de zuurgroep. De verbinding is vooral bekend als daterapedrug.
Wel Kop maar geen KopLevel aangegeven
| Aantal C | Systematische naam zuur | Triviale naam zuur | Triviale naam zuurrest | Systematische naam zuurrest |
|---|---|---|---|---|
| Verzadigde zuren | ||||
| 1 | Methaanzuur | Mierenzuur | Formiaat | Methanoaat |
| 2 | Ethaanzuur | Azijnzuur | Acetaat | Ethanoaat |
| 2 | Ethaandizuur | Oxaalzuur | Oxalaat | Oxalaat |
| 3 | Propaanzuur | Propionzuur | Propionaat | Propanoaat |
| 3 | Propaandizuur | Malonzuur | Malonaat | Malonaat |
| 4 | Butaanzuur | Boterzuur | Butyraat | Butanoaat |
| 4 | Butaandizuur | Barnsteenzuur | Succinaat | Succinaat |
| 4 | 2-Hydroxybutaandizuur | Appelzuur | Malaat | Malaat |
| 4 | 2-Oxobutaandizuur | Oxaalazijnzuur | Oxaalacetaat | Oxaalacetaat |
| 4 | 2,3-Dihydroxybutaandizuur | Wijnsteenzuur | Tartraat | tartraat |
| 18 | Octadecaanzuur | Stearinezuur | Octadecanoaat | Stearaat |
| Onverzadigde zuren | ||||
| 18 | Octadec-9-eenzuur | Oliezuur | Octadecenoaat | Oleaat |
| Aromatische zuren | ||||
| 7 | Benzeencarbonzuur | Benzoëzuur | Benzeencarboxylaat | Benzoaat |
| 7 | 2-Hydroxybenzeen-carbonzuur | Salicylzuur | 2-Hydroxybenzeen-carboxylaat | Salicylaat |
Waarom zijn carbonzuren zuur?
Nadat de carbonzuurgroep zijn waterstof-ion heeft afgestaan is de negatieve lading op het zuurstof-atoom achtergebleven. De negatieve lading kan makkelijk tussen de twee zuurstof-atomen op en neer stromen, en eigenlijk gaat dat zo snel dat je van buiten niet kunt zeggen op welk van de twee zuurstof-atomen de lading aanwezig is. Van buiten ziet het er uit alsof elk zuurstof-atoom een halve negatieve lading heeft.
Vanuit de natuurkunde is bekend dat het samenbrengen van lading in een kleinere ruimte energie (moeite) kost. Lading over een grotere ruimte verspreiden levert dus energie. Het is dus voor het carbonzuur veel gunstiger om zijn waterstof-ion af te staan dan voor een alkanol.
Hieronder zie je naast elkaar het carbonzuur, het carboxylaat-ion dat eruit ontstaat en rechts de verdeling van de lading over de twee zuurstof-atomen.
Carboxylaat
Naamgeving in combinaties
combinaties
Waarschuwing bij gehalogeneerde azijnzuren
| Aantal halogeen | Naam | Formule | smeltpunt (°C) | kookpunt (°C) | pKz |
|---|---|---|---|---|---|
| 0 | Fosforzuur | 2,15 | |||
| 0 | Azijnzuur | 17 | 118 | 4,75 | |
| 1 | Fluorazijnzuur | 35 | 168 | 2,59 | |
| 2 | Difluorazijnzuur | -1 | 133 | ||
| 3 | Trifluorazijnzuur | -15 | 72 | 0,23 | |
| 1 | Chloorazijnzuur | 61 | 189 | 2,87 | |
| 2 | Dichloorazijnzuur | 14 | 193 | 1,26 | |
| 3 | Trichloorazijnzuur | 58 | 198 | 0,66 | |
| 1 | Broomazijnzuur | 49 | 208 | 2,86 | |
| 2 | Dibroomazijnzuur | ||||
| 3 | Tribroomazijnzuur | 132 | 245 | 0,72 |
- ↑ De gegevens zijn ontleend aan de Nederlandstalige Wikipedia op 15 augustus 2021. De getallen zijn afgerond op hele graden Celsius
- ↑ De wetenschappelijke notatie bij methaanzuur is uiteraard 1,78*10-4. In de gebruikte notatie is duidelijk dat het kleinste carbonzuur een stuk sterker is dan de overige leden van de serie. De tweede decimaal is eigenlijk niet terecht.


