Basiskennis chemie 3/Organische chemie, vertakte alkanen
Alkanen bouwen
Bij propaan ontstaat een nieuwe situatie. Er zijn nu twee soorten koolstofatomen:
- 2 koolstof-atomen die maar aan één ander koolstof-atoom gekoppeld zijn en
- 1 koolstof-atoom dat aan twee andere koolstof-atomen gekoppeld is.
Het koppelen van een vierde koolstof-atoom kan nu op twee verschillende manieren:
- aan één van de koolstof-atomen aan het eind van het sliertje, dan krijg je vier koolstof-atomen op rij. Vier koolstof-atomen op rij vormen het koolstof-skelet van butaan. En
- aan het middelste koolstof-atoom, er ontstaat dan een soort sterretje van koolstof-atomen.
Toen de sterretjes-variatie van butaan gevonden werd, was de recht toe recht aan versie al lang bekend. Dat was de normale soort butaan, normaal-butaan of n-butaan. De sterretjes-variatie kreeg de naam iso-butaan of i-butaan. Iso is het Griekse woord voor "gelijk".
n-Butaan
iso-Butaan
i-Butaan
Worden de waterstof-atomen aan de vrije bindingen van de koolstof-skeletten gekoppeld dan zijn in beide gevallen 10 waterstof-atomen nodig. Ook van het vertakte alkaan is de algemene formule . Je kan dat ook zien als je je realiseert dat om isobutaan uit propaan te "maken", je
- van het middelste koolstof-atoom één waterstof-atoom moet losmaken
- aan de ontstane vrije binding aan het middelste koolstof-atoom een -groep moet koppelen. Koolstof heeft in een -groep nog twee bindingen vrij, een daarvan wordt nu gebruikt om deze groep aan het propaan-molecuul te binden, de andere is nog steeds vrij.
- tenslotte koppel je het losgemaakte waterstof aan de nog vrije binding van de -groep.
Ga je op dezelfde manier als hierboven te werk om van een molecuul met vier koolstof-atomen een molecuul met vijf koolstof-atomen te maken dan betekent het dat we in ieder geval met twee verschillende moleculen met vier koolstof-atomen vertrekken.
n-Butaan geeft:
| n-Butaan | n-Pentaan | i-Pentaan | |
 |
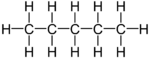 |
 |
Figuur 2 |
en voor i-Butaan vind je:
| i-Butaan | i-Pentaan | neo-Pentaan | |
 |
 |
 |
Figuur 3 |
In figuur 2 ontstaat de middelste verbinding door aan een van de einden van de koolstofsliert een extra koolstof-atoom te koppelen. Dit was de normale vorm van pentaan, n-pentaan.
Door in de bovenste rijfiguur 2 het extra koolstof-atoom aan een van de middelste koolstof-atomen vast te maken ontstaat iso-pentaan.
In figuur 3 ontstaat ook iso-pentaan door het extra koolstof-atoom juist aan een koolstof-atoom te koppelen dat maar aan een andere is gekoppeld.
Nadat n-pentaan en i-pentaan gevonden waren werd er nog een nieuw soort pentaan ontdekt. Het extra koolstof-atoom was in i-butaan aan het centrale koolstof-atoom vastgezet. De nieuwe pentaansoort werd neo-pentaan genoemd. "Neo" is het Griekse woord voor "nieuw".
Uit het feit dat de verschillende verbindingen met 4 koolstofatomen, ondanks de zelfde samenstelling als je alleen naar de aantallen atomen kijkt, duidelijk verschillende eigenschappen hebben, is duidelijk dat het echt om verschillende verbindingen gaat. Het zelfde geldt voor de verschillende verbindingen met de formule .
Het aantal mogelijke isomeren neemt snel toe met het aantal koolstof-atomen. In onderstaande tabel is voor een aantal alkanen aangegeven hoeveel isomeren er mogelijk zijn.
| alkaan | aantal koolstof |
aantal isomeren[1] |
details isomerie |
|---|---|---|---|
| Methaan | 1 | 1 | |
| Ethaan | 2 | 1 | |
| Propaan | 3 | 1 | |
| Butaan | 4 | 2 | Zie hierboven |
| Pentaan | 5 | 3 | Zie lijst |
| Hexaan | 6 | 5 | Zie lijst |
| Heptaan | 7 | 9 | Zie lijst |
| Octaan | 8 | 18 | Zie lijst |
| Nonaan | 9 | 35 | Zie lijst |
| Decaan | 10 | 75 | Zie lijst |
| Undecaan | 11 | 159 | Zie lijst |
| Dodecaan | 12 | 355 | Zie lijst |
| Tridecaan | 13 | 802 | Zie lijst |
| Tetradecaan | 14 | 1855 | Zie lijst |
| Pentadecaan | 15 | 4347 | |
| Eicosaan | 20 | 366.319 |
Namen voor alkylgroepen
Voor de onvertakte alkanen waren inmiddels de namen internationaal vastgelegd, maar voor vertakte alkanen moest een uitbreiding worden bedacht. De uitbreiding gaat in twee stappen:
- Zoek de langste keten aaneengekoppelde koolstof-atomen. Deze krijgt op de zelfde manier een naam als bij de onvertakte alkanen.
- De stukken van het molecuul die niet bij de hoofdketen horen krijgen een naam die lijkt op die van het alkaan met hetzelfde aantal koolstof-atomen, alleen de uitgang ~aan wordt vervangen door de uitgang ~yl.
Plaatsnummers en meer van dezelfde substituent
De naam methylpentaan klinkt eenduidig, maar de methylgroep kan wel op twee verschillende plaatsen zitten: aan het koolstof-atoom in het midden van de sliert en aan een van de koolstofatomen net naast het einde van de keten. Door de keten om het middelste koolstof-atoom te draaien worden deze twee koolstofatomen gelijk. Het onderscheid tussen de twee verbindingen wordt gemaakt door het nummer van het koolstofatoom aan te geven waar de methylgroep aan vast zit. De keten wordt zo genummerd dat een zo laag mogelijk nummer zo vroeg mogelijk in de naam staat. Hieronder staan de eigenschappen van de twee verbindingen.
Als een bepaalde substituent meerdere keren voorkomt, worden de Griekse telwoorden gebruikt om het aantal aan te geven. De telwoorden worden niet gebruikt bij de volgorde-bepaling van de substituenten zoals je in het tweede voorbeeld hieronder ziet.
| Figuur 4 | ||
| 2,3,6-trimethylheptaan | 3-ethyl-2,4-dimethylhexaan |
Wel Kop maar geen KopLevel aangegeven
Uiteraard kunnen ook cyclische alkanen substituenten bevatten. Hieronderstaan een aantal voorbeelden.
| Figuur 5 | |||
| methylcyclopropaan | methylcyclohexaan | 1-ethyl-1,3-dimethylcyclohexaan |
Substituenten met substituenten
Tot nu toe heb je, als het om substituenten ging alleen naar lineaire alkylgroepen gekeken. Het grote aantal isomeren van decaan is niet mogelijk als substituenten zelf ook niet weer substituenten konden dragen. De regels voor namen zijn als volgt:
- Zoek de langste keten.
- Kijk welke groepen als substituent optreden
- Als een substituent zelf ook substituent(en) heeft geldt:
- De nummering langs de hoofdsubstituent start met "1" waar deze aan de hoofdketen is verbonden.
- De substituenten aan de hoofdsubstituent worden alfabetisch gerangschikt
- Eventuele Griekse telwoorden worden bij de substituenten geplaatst
- De naam van de substituent wordt nu samengesteld, en eindigt op ~yl
- Als alle vertakte substituenten op deze manier van een naam voorzien zijn worden ze, samen met de onvertakte substituenten gealfabetiseerd. Eventuele telwoorden in de naam van vertakte substituenten worden nu wel mee gealfabetiseerd. Plaatscijfers in vertakte substituenten worden niet mee gealfabetiseerd.
- De naam van de verbinding wordt nu samengesteld. De namen van de vertakte substituenten worden voorafgegaan door hun plaatsnummers (tussen streepjes) en tussen ronde haakjes gezet.
In onderstaande figuur en de tekst erna is een ander uitgewerkt:
- De langste keten heeft 5 koolstofatomen: pentaan
- Een groep met als langste rij twee koolstof-atomen treedt op als hoofdsubstituent ethyl
- Deze substituent heeft zelf ook een substituent
- De substituent van de hoofdsubstituent is gekoppeld aan het eerste koolstof-atoom
- De substituent van de hoofdsubstituent heeft één koolstof-atoom: methyl
- Telwoorden zijn niet nodig, want het is er maar 1.
- De naam van de substituerende groep is: 1-methylethyl
- De twee andere substituenten zijn niet vertakt en hebben maar één koolstof-atoom: methyl. Dat alfabetiseert voor methyl-ethyl. De rij substituenten wordt dus: 2,4-dimethyl, 3-(1-methylethyl).
- De naam van de verbinding is dan: 2,4-dimethyl-3-(1-methylethyl)pentaan.
- ↑ Constitutional Isomers of Alkanes geraadpleegd op 7 juni 2016






